इस article मे हम हाइड्रोजन परमाणु ( hydrogen spectrum in hindi ) के स्पेक्टम के बारे मे सरल व आसान भाषा मे जानेंगे की हाइड्रोजन स्पेक्ट्रम क्या होता है तथा इसकी कितनी श्रेणिया होती है व इनके तरंगदैर्ध्य का क्या सूत्र होता है
हाइड्रोजन स्पेक्ट्रम –
हाइड्रोजन परमाणु स्पेक्ट्रम का सबसे से पहले सन् 1885 मे अध्ध्यन किया हाइड्रोजन एकल इलेक्ट्रॉन वाला परमाणु है और इसका यह इलेक्ट्रॉन एकल प्रोटोन वाले नाभिक के चारो ओर चक्कर लगाता रहता है जिस से इसका एक सरल स्पेक्ट्रम प्राप्त होता है
हाइड्रोजन परमाणु को विसर्ग नलिका मे लेकर बहुत कम दाब पर विधुत धारा प्रवाह किया जाता है और इस से जो विकिरण उत्सर्जित होती है होती है इस विकिरणो के लिए विभिन्न श्रेणिया मिलती है और हर श्रेणी के लिए एक निश्चित तरंग संरचना होती है ये श्रेणिया निम्न होती है
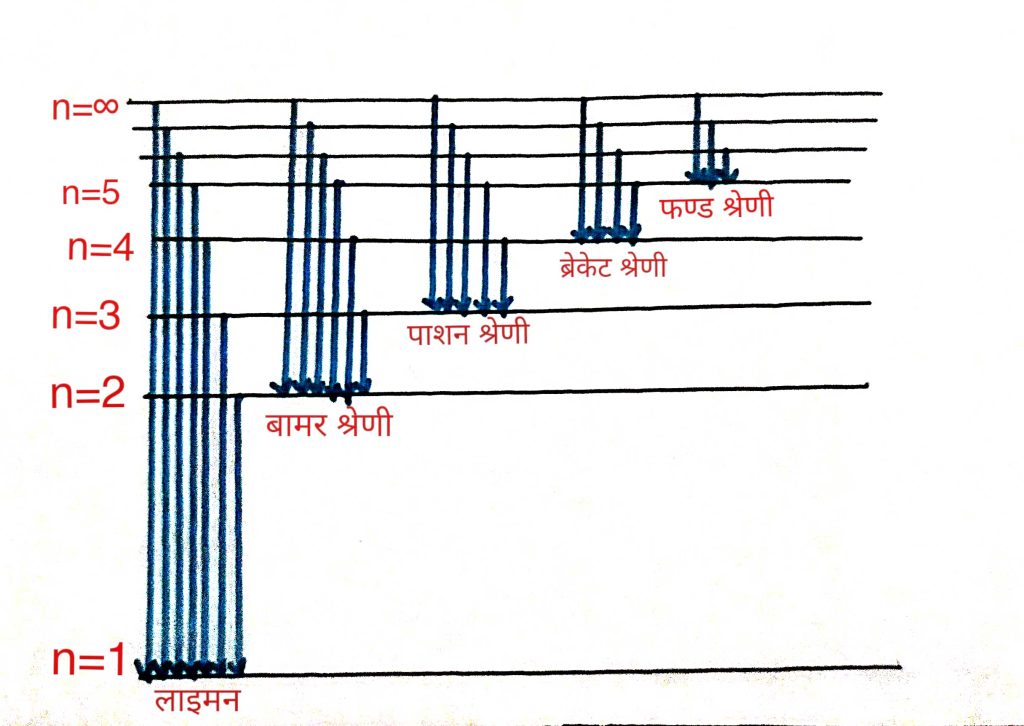
लाइमन श्रेणी –
यह श्रेणी हाइड्रोजन परमाणु के इलेक्ट्रॉन की दूसरी , तीसरी, चौथ आदि कक्षो के पहली कक्षा मे स्थानांतरित होने वाली उत्सर्जित विकिरण से प्राप्त होती है
यह चरम बैंगनी रंग भाग मे प्राप्त होती है तथा इसकी तरंग तरंगदैर्ध्य निम्न सूत्र से ज्ञात की जाती है
1/λ = R(1/1² = 1/n²)
जहाँ n = 1,2,3,4,……∞
बामर श्रेणी –
इस श्रेणी मे हाइड्रोजन परमाणु के इलेक्ट्रॉन दूसरी, तीसरी, आदि कक्षाओं से दूसरी कक्षा मे संक्रमण करता है यह दृश्य क्षेत्र मे होती है
इसकी तरंगदैर्ध्य निम्न सूत्र से ज्ञात की जाती है
1/λ = R(1/2² = 1/n²)
जहाँ n = 3,4,5……∞
पशान श्रेणी –
इस श्रेणी मे हाइड्रोजन परमाणु के इलेक्ट्रॉन चौथी, पांचवी आदि कक्षाओं से तीसरी कक्षा मे संक्रमण करता है यह अवरक्त क्षेत्र मे होती है
इसकी तरंगदैर्ध्य निम्न सूत्र से ज्ञात की जाती है
1/λ = R(1/3² = 1/n²)
जहाँ n = 4,5,6……∞
ब्रकेट श्रेणी –
इस श्रेणी मे हाइड्रोजन परमाणु के इलेक्ट्रॉन पांचवी, छठी आदि कक्षाओं से चौथी कक्षा मे संक्रमण करता है यह चरम अवरक्त क्षेत्र मे होती है
इसकी तरंगदैर्ध्य निम्न सूत्र से ज्ञात की जाती है
1/λ = R(1/4² = 1/n²)
जहाँ n = 5,6,7……∞
फण्ड श्रेणी –
इस श्रेणी मे हाइड्रोजन परमाणु के इलेक्ट्रॉन छठी, सातवी आदि कक्षाओं से पांचवी कक्षा मे संक्रमण करता है यह भी परम अवरक्त क्षेत्र में होती है
इसकी तरंगदैर्ध्य निम्न सूत्र से ज्ञात की जाती है
1/λ = R(1/5² = 1/n²)
जहाँ n = 6,7,8……∞

Leave a Reply