विद्युत अपघट्य तथा विद्युत अनअपघट्य क्या है । describe Electrolytic in hindi। इस पोस्ट मे विद्युत अपघट्य, विद्युत अनअपघट्य को हमारे द्वारा सरलता से आपको सम्पूर्ण जानकारी दि जायेगी। इस पोस्ट में इसके उदाहरण तथा प्रकारो की जानकारी मौजूद है यह पोस्ट वैद्युत रसायन का बेसिक है जो बहुत महत्वपूर्ण है क्योंकि इसमें पदार्थों की रासायनिक क्रिया से हम विद्युत ऊर्जा को जनरेट करने मे कौन कौन से विद्युत अपघट्य पदार्थो का प्रयोग होगा उसके बारे मे भी बताया जायेगा ।
विद्युत अपघट्य किसे कहते हैं एंव इसके प्रकार
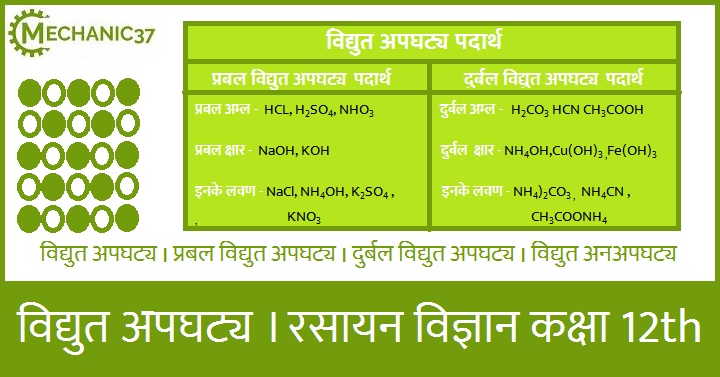
विद्युत अपघट्य
विद्युत अपघट्य वह पदार्थ जिसको हम जब जल में घोलते हैं तो वह ऋण आयन तथा धनायन में टूट जाता है अर्थात कुछ ऐसे भी पदार्थ होते हैं उसे जिसमें इलेक्ट्रॉन मुक्त होते हैं जो उस पदार्थ को विद्युत चालक बनाने का कार्य करते हैं । तो ऐसे पदार्थ को हम विद्युत अपघट्य ( Electrolytic )कहते हैं विद्युत अपघट्य पदार्थ हमेशा अम्लों, क्षारों एवं लवणों के विलयन के रूप में पाए जाते हैं एवं ऐसी कुछ गैसे भी है जो विद्युत अपघट्य पदार्थ के भांति कार्य करती है । जैसे, सोडियम क्लोराइड ( Nacl ) , पोटेशियम क्लोराइड ( Kcl ), डीएनए(DNA), पॉलीपेप्टाइड्स एंव पॉलीस्टरीन सल्फोनेट इनके विलयनो को भी विद्युत अपघट्य करते हैं। विद्युत अपघट्य मुख्य रूप से दो प्रकार के होते हैं ।
प्रबल विद्युत अपघट्य
वह विद्युत अपघट्य जिनको हम जब जल मे घोलते हैं तो वहां पूरी तरह से वे ऋण आयन तथा धनायन में टूट जाते हैं इस प्रकार के विद्युत अपघट्य को हम प्रबल विद्युत अपघट्य कहते हैं। प्रबल विद्युत अपघट्य के जलीय विलयन की विद्युत चालकता का मान अधिक होता हैं जैसे सोडियम क्लोराइड( Nacl ) पोटेशियम क्लोराइड( KCl ) HCl NaOH NaCl NH4Cl CH3COONa आदि ये सभी प्रबल विद्युत अपघट्य है।
दुर्बल विद्युत अपघट्य
वह विद्युत अपघट्य जिसको जल में घोले जाने पर वह आंशिक रूप से या कम मात्रा में धनायन तथा ऋण आयन में टूट जाता है ऐसे विद्युत अपघट्य को हम दुर्बल विद्युत अपघट्य कहते हैं एवं इनके जलीय विलयन की विद्युत चालकता का मान कम पाया जाता है जैसे, अमोनियम हाइड्रोक्साइड ( Nh4OH ), एसिटिक अम्ल ( CH3COOH ) H2CO3 CH3COONH4 आदि ये सभी दुर्बल विद्युत अपघट्य है।
विद्युत अनअपघट्य
वह पदार्थ जिसको हम जब जल में घोला जाता है तो वह धनायन तथा ऋण आयन में नहीं टूटता है तो इस प्रकार का पदार्थ विद्युत अनअपघट्य कहलाता हैं अर्थात दूसरे शब्दों में हम कह सकते हैं की ऐसे पदार्थ का विलयन जो विद्युत अचालक हो अर्थात विद्युत प्रवाह ना हो सकें ऐसे योगिक विद्युत अनअपघट्य कहलाते हैं । जैसे ग्लूकोज, एथिल अल्कोहल एवं कार्बनिक योगिक यूरिया चीनी आदि ये सभी विद्युत अनअपघट्य के उदाहरण है ।
विद्युत अपघटन
इसे हम प्रकार से परिभाषित कर सकते हैं जब किसी विद्युत अपघट्य के जलीय विलयन में से हम जब विद्युत धारा को प्रवाहित करते हैं तो उस विलयन में अनेक रासायनिक क्रियाऐं संपन्न होती हैं जिन्हें हम विद्युत अपघटन कहते हैं विद्युत अपघटन की क्रियाएं निम्न है जो गलित अवस्था में अलग होती है जबकि विलयन अवस्था में अलग होती है जैसे,
गलित अवस्था में :- जब नमक को अधिक तापमान पर गलाया जाता है फिर उसे एक पात्र में इकट्ठा कर लेते हैं और इस पात्र में एक इलेक्ट्रॉन और कैथोड लगा देते हैं जिससे इसमें यह क्रिया होती है इस अभिक्रिया में एनोड पर ऑक्सीकरण होता है यहां पर हमें क्लोरीन मिलती है जबकि कैथोड पर अब चैन की अभिक्रिया होती है यहां पर हमें सोडियम मिलता है
Nacl ↔ Na+ + cl–
यह गलित अवस्था मे नमक की टुटने की प्रवर्ति है जो Na+ मे तथा cl– मे टुट जाता है
नमक की ऐनॉड पर ऑक्सीकरण अभीक्रिया जबकि कैथोड पर अपचयन अभिक्रिया होती है जैसे,
ऐनॉड पर, Cl– → Cl +e– (ऑक्सीकरण अभिक्रिया)
Cl+Cl → Cl2͢
कैथोड पर, Na+ + e– → Na (अपचयन)
विलयन अवस्था में :- जब नमक को HOH विलयन के साथ मिलाकर एक विलयन मनाया जाता है इसमें एक एनोड और कैथोड की छड़ को डुबोया जाता है इस में एनोड पर हमें ऑक्सीकरण अभिक्रिया होती है एवं क्लोरीन गैस निकलती है जबकि कैथोड पर अपचयन अभिक्रिया होती है इसमें हाइड्रोजन गैस निकलती है एवं इस पुरी अभिक्रिया के उपरांत पात्र में NaOH रह जाता है
विलयन Nacl ↔ Na+ + cl–
HOH → H+ + OH–
ऐनॉड पर, Cl– → Cl + e– (ऑक्सीकरण अभिक्रिया)
Cl+Cl → Cl2 ↑
कैथोड पर, H+ +e– → H (अपचयन अभिक्रिया)
H + H → H2 ↑
Na+ + OH– → NaOH
विद्युत अपघटन के फैराडे के नियम
फैराडे का प्रथम नियम ;- इस नियम के द्वारा में ज्ञात होता है कि जब किसी विद्युत अपघट्य पदार्थ से बने विलयन में हम जब विद्युत धारा प्रवाहित करते हैं तो इलेक्ट्रोड से जो पदार्थ मुक्त होता है उसकी मात्रा उस विलयन को दिए गए विद्युतीय आवेश के समानुपाती होती है इसे हम w प्रतिक के द्वारा निरूपित करते हैं इसे हम निम्न समीकरण द्वारा दर्शाते हैं
w ∝ Q [ w = पदार्थ कि मात्रा , Q = विधुत आवेश ]
w=Z Q [Z = विधुत रसायनिक तुल्यांक ]
w=Z I T [ I = 1 amp , T = 1 sec ]
w=Z [ Z= E/96500 ]
विद्युत रासायनिक तुल्यांक :- इसे हमने न प्रकार से परिभाषित कर सकते हैं जब किसी विद्युत अपघट्य से बने विलयन में से 1 एंपियर की विद्युत दाता धारा को 1 सेकंड तक प्रभावित करते हैं तो जिसके कारण से इलेक्ट्रोडों जो पदार्थ मुक्त होता है उसे ही हम विद्युत रासायनिक तुल्यांक कहते हैं इसे हम Z प्रतीक द्वारा निरूपित कर सकते हैं
फैराडे का द्वितीय नियम :- इसे भी हम निम्न प्रकार से परिभाषित कर सकते हैं जैसे यदि भिन्न भिन्न विद्युत अपघट्य के विलयन में समान आवेशों की जब विद्युत धारा को समान समय के लिए प्रवाहित करते हैं तो जिसके कारण से इलेक्ट्रोडों से जो पदार्थों की मात्रा मुक्त होती है वह रासायनिक तुल्यांकों के समान होती है।
पहले पदार्थ की मात्रा दुसरे पदार्थ की मात्रा
w1∝Q w2∝Q
w1=E1 Q w2=E2 Q [E= रासायनिक तुल्यांक]
w1/E1 = Q w2/E2 = Q
w1=Z1 IT w2=Z2 IT
दोनो समीकरण को आपस मे मिलाने पर
Z1 IT/E1 = Z2 IT/E2
Z1/Z2 =E1/E2
इसलिए हम कह सकते है कि विद्युत रासायनिक तुल्यांक तथा रासायनिक तुल्यांक आपस मे समानुपाती होते है अर्थात Z∝E |
विद्युत अपघट्य, विद्युत अनअपघट्य को हमने कक्षा 12वीं के रसायन विज्ञान के पाठ 3 के विद्युत रसायन से लिया गया है । इसके 2 भाग हमारे द्वारा पहले पोस्ट कर दिए हैं यह विद्युत रसायन का तीसरा भाग है यदि आप पोस्ट आपको पसंद आए तो आप इसे अपने दोस्तों को शेयर करें तथा हमें अपनी प्रतिक्रिया कमेंट बॉक्स में कमेंट करके बताएं यदि आपने हमारी वेबसाइट को सब्सक्राइब नहीं किया है तो इसे सब्सक्राइब कर ले जिससे हमारी लेटेस्ट पोस्ट आपको डायरेक्ट मिल जाएगी । धन्यवाद ।

Leave a Reply